Le trajet des stéroïdes dans le corps
Les stéroïdes anabolisants, dits aussi stéroïdes androgéniques anabolisants ou SAA, sont des dérivés de synthèse de la testostérone, qui est une hormone naturellement présente principalement chez l’homme et dont les modifications chimiques en laboratoire ont réduit les effets androgéniques. Ces effets androgéniques désignent par exemple la masculinisation de la voix qui devient plus grave, l’accroissement du système pileux corporel et facial ou encore le développement des organes sexuels secondaire mâles ; ces effets, bien que toujours présents suite à la prise de stéroïdes, ne sont pas ceux recherchés. Ce sont plutôt les effets anabolisants qui favorisent la formation tissulaire et donc la croissance musculaire. Le développement du volume des muscles ainsi que de leur puissance, la diminution des graisses corporelles ou encore la réduction du temps de récupération étant les but recherchés par les culturistes, la prise de stéroïdes anabolisants peut sembler un moyen efficace pour accroître leur puissance musculaire rapidement et aller au delà des limites que leur corps leur impose obligatoirement de manière naturelle.
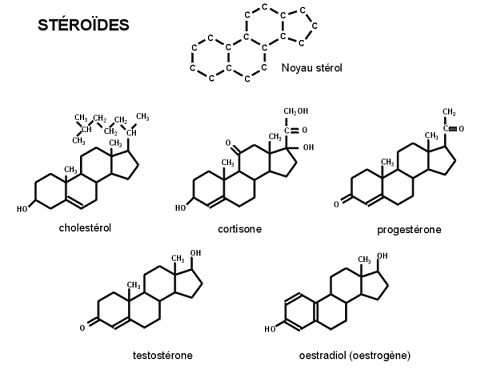
La molécule à l'origine de la testostérone est le cholestérol.
Schéma d'une molécule de cholestérol
En effet, la molécule de cholestérol va être transportée du cytosol jusqu'à la membrane interne de la mitochondrie grâce à la protéine StAR (Steroidogenic Acute Regulatory protein). Grâce à l'action d'enzymes, le cholestérol va être converti en prégnénolone puis va quitter la membrane interne de la mitochondrie pour rejoindre ce qu'on appelle la membrane du réticulum. Après une autre suite de réactions enzymatiques, le prégnénolone sera ainsi converti en testostérone ou en autres hormones sexuelles qui possèdent la même base structurelle : le noyau stérol.
Hormones sexuelles dérivées du cholestérol
La molécule stéroïdienne synthétisée est donc composée d'une structure très proche de celle de la testostérone, molécule elle-même synthétisée par le cholestérol.
Schéma de la structure chimique de l’hormone de synthèse : méthandrosténolone (Dianabol, DBOL).
Il existe plusieurs modes d’administration des stéroïdes ; la voie orale, la voie transdermique et l’injection. Les voies orale et transdermique peuvent être problématiques car d’un côté la voie orale entraîne des effets non négligeables : les voies digestives peuvent être irritées, le foie très sollicité, et le système urinaire, qui cherche naturellement à éliminer la molécule, est mis à l’épreuve. D’un autre côté la voie trans-dermique peut engendrer une pousse de poils à l’endroit de l’application locale, il existe également une déperdition de la substance active et la contamination d’une personne à proximité est envisageable. C’est pourquoi l’injection intramusculaire est privilégiée ; les stéroïdes sont injectés directement dans le sang.
Une fois injectés, les stéroïdes anabolisants se propagent dans le sang sous forme de plusieurs molécules qui transportent un message destiné à des cellules précises du corps. Les stéroïdes anabolisants sont des molécules lipophiles, ce qui signifie qu’elles ont ce qu’on appelle une affinité pour les solvants dits apolaires, qui sont les corps gras. Par conséquent elles sont également hydrophobes ; elles ne sont pas solubles dans l’eau. Ainsi le sang, qui peut s’apparenter à l'eau, ne permettent pas aux protéines de s’y déplacer librement ; des protéines de transport interviennent pour les transporter vers la cellule cible.
Schéma de la molécule lipophile de cholestérol : sa chaîne hydrocarbonée (carbone + hydrogène) est hydrophobe et son groupe polaire OH est hydrophile
Une fois arrivée au niveau des capillaires sanguins qui irriguent les muscles ciblés, la protéine de fixation libère l’hormone stéroïde qui devient active et qui, comme certains gaz et autres molécules lipophiles, va traverser la membrane plasmique appelée bicouche lipidique par diffusion passive, c’est-à-dire qu’aucun apport énergétique n’est nécessaire de la part de la cellule car la molécule est, rappelons-le, lipophile.
La bicouche lipidique membranaire constitue une barrière imperméable aux ions (Na+, K+...) , aux molécules polaires comme le glucose, et aux protéines. En revanche elle est perméable aux molécules non polaires dites lipophiles ou hydrophobes dont font partie les stéroïdes, et aux molécules à l’état gazeux (O2,CO2…).
Schéma de l’imperméabilité de la double couche lipophile
Une fois la membrane plasmique traversée, les stéroïdes se fixent sur des récepteurs libres intracellulaires présents dans le cytoplasme, les récepteurs aux androgènes (RA). Ce sont des récepteurs nucléaires. Ils désignent une superfamille de facteurs transcriptionnels activés par un ligand, qui est une molécule se liant de manière réversible à ces récepteurs, ici l’hormone stéroïdienne.
Le fait que la composition du stéroïde synthétisé se rapproche de celle de la testostérone va permettre à la molécule stéroïdienne de leurrer le récepteurs et donc de se lier à celui-ci.
Il existe 48 récepteurs nucléaires identifiés dans le génome humain, classés en 3 grands familles :
-
La première classe correspond aux récepteurs possédant une affinité aux hormones stéroïdiennes. On peut citer les récepteur des oestrogènes (ERα et ERβ), de la progestérone (PR), des androgènes (AR), des glucocorticoïdes (GR) ou encore des minéralocorticoïdes (MR).
-
La deuxième classe correspond aux récepteurs des hormones thyroïdiennes et de l’acide rétinoïque, avec par exemple le récepteur de la thyroxine (TR).
-
La dernière classe regroupe les récepteurs orphelins, qui regroupent des récepteurs sans ligand identifié. Par exemple on y trouve le LXR (Liver X Receptor).
La structure des récepteurs est conservée par tous les membres de cette super-famille ; un récepteur nucléaire est divisé en 4 régions égalements appelées domaines qui sont encore subdivisibles : on les nommes A/B, C, D et E/F.
Schéma de la structure d'un récepteur nucléaire
-
Le domaine A/B correspond au domaine d’activation de la transcription (TAD)
-
Le domaine C est le domaine central (DBD), et qui est impliqué dans la fixation à l’ADN ainsi que dans la dimérisation du récepteur.
-
Le domaine D est le domaine permettant au ligand, d’être transféré dans le noyau de la cellule par signal de localisation nucléaire (NLS)
-
Le domaine E/F est le domaine de fixation du ligand (LBD) par l’homo ou hétérodimérisation du récepteur et joue un rôle dans l’activation de la transcription.
Les classes 2 et 3 vont entraîner des hétérodimère, tandis que pour les récepteurs des hormones stéroïdiennes, on assistera à des homodimères. Les interfaces correspondant à la dimérisation se situent dans le domaine de liaison au ligand E/F et dans le domaine de liaison à l’ADN C.
Le ligand, ici l’hormone stéroïde, va donc se fixer sur le récepteur nucléaire dans le cytosol au niveau du LBD où se trouve une poche hydrophobe, dans laquelle l’hormone stéroïde, lipophile, peut venir se fixer.
Lorsque le récepteur ne possède pas de ligand, sa conformation est inactive à cause de sa liaison avec une protéine de choc thermique appelée HSP (Heat Shock Protein).
Une fois le ligand fixé sur le récepteur, celui-ci se retrouve activé par la dissociation de l’HSP et le complexe hormone-récepteur HR peut être libéré.
Schéma de l’activation du complexe hormone-récepteur
Le domaine LBD des récepteurs nucléaires adopte un repliement qu’on appelle "sandwich d’hélices". En effet il est composé de 12 hélices α numérotées de H1 (au niveau de l’extrémité dite amino-terminale) à H12 (au niveau de l’extrémité dite carboxy-terminale) arrangées en trois couches. Le site de liaison du ligand est déterminé par les deux courts feuillets ß qui forme une poche hydrophobe. On dit que les hélices H1 à H11 représentent le coeur du domaine, et l’hélice H12 pointe vers l’extérieur de ce coeur lorsqu’il n’y a pas de ligand.
Schéma de la structure du LBD (domaine de fixation du ligand) en absence de ligand
Lors de la fixation du ligand sur le domaine dit LBD, la structure tri-dimensionnelle de ses hélices va subir une modification. Après la pénétration du ligand dans la poche hydrophobe, l’hélice H12, originellement pointée vers l’extérieur, se replie de manière à "boucher" la cavité comme un couvercle (hélice représentée en violet sur le schéma). C'est ce qu'on appelle le modèle "piège à souris". De plus le LBD va subir une compaction générale ce qui va stabiliser les dimères sur leur HRE. Finalement cette modification structurelle va permettre de créer une nouvelle surface de fixation pour les co-activateurs transcriptionnels qui joueront un rôle lors de la transcription.
Schéma de la modification de la structure tri-dimensionnelle du domaine LBD après la fixation du ligand (ligand non représenté)
Le complexe HR s’insinue dans le noyau grâce au domaine D avec son signal de localisation nucléaire par les pores nucléaires et, maintenant activé, va pouvoir venir se fixer sur une séquence spécifique de l’ADN que l’on appelle élément de réponse à l’hormone (HRE : Hormone Responsive Element). Les récepteurs nucléaires ayant une affinité pour les hormones stéroïdes reconnaissent des séquences de deux demi-éléments hexanucléotidiques (6 nucléotides) séparés par un nombre variable de nucléotides. Ces demi-sites, dans le cas des hormones stéroïdiennes, se trouvent sous une forme de répétition inversée (=un palindrome, qui est une séquence que l’on peut lire identiquement de gauche à droite que de droite à gauche sur la séquence complémentaire) de par l'homodimérisation (IR : répetition indirecte) qui permet la fixation du HR sur le bon HRE.
Suite à cela, les molécules stéroïdiennes vont se fixer aux brins d’ADN qui vont être transcrits. Cela va se faire grâce aux affinités chimiques qui vont se créer au niveau moléculaire, tel que les liaisons H entre les nucléotides où la molécules stéroïdienne va venir se fixer.
Schéma de la liaison de récepteurs nucléaires par homodimérisation
Ce complexe va alors se fixer sur l’élément de réponse de l’ADN grâce au domaine DBD qui est constituée d’une séquence peptidique d’environ 66 à 68 acides aminés et qui adoptent une structure dite en doigt de zinc de type C4 (4 cystéines) avec deux sous-domaine : la boîte proximale dite P-box et la boîte distale appelée D-box. La structure hélicoïdale de la P-box permet un contact direct avec les grands sillons de l’ADN au niveau des HRE, et les acides aminés de la D-box sont importants pour la dimérisation du récepteur.
Schéma de la liaison du domaine DBD avec l'ADN par la P-box et de l'homo-dimérisation des récepteurs par la D-box
Cette fixation va conduire au recrutement de co-activateurs (co-A) possédant une activité histone acétyltransférase (HAT) comme par exemple la protéine p160/SRC (Steroid Receptor Co activator), ce qui correspond à leur capacité à acétyler des histones. L’acétylation correspond à la modification de l’affinité des histones pour l’ADN et du relâchement de leur interaction moléculaire. En clair, ce processus va permettre un remodelage de la chromatine qui correspond à une ouverture et donc un accès des molécules de la machinerie transcriptionnelle aux promoteurs des gênes. Tout ce processus permet une meilleure disponibilité de l’ADN pour accueillir l’ARN polymérase et ainsi transcrire les gènes concernés ; on a une activation de la transcription.
Schéma de l'acétylation des histones par le remodelage de la chromatine
Comme vu précédemment, la composition chimique des stéroïdes est très similaire à celle des hormones sexuelles naturellement sécrétées par le corps humain comme la testostérone. Le fait que leurs compositions soient très proches va permettre aux molécules stéroïdiennes de leurrer les récepteurs et donc de se lier à ceux-ci. Suite à cela, les molécules stéroïdiennes vont se fixer aux brins d’ADN qui vont être transcrits. Cela va se faire grâce aux affinités chimiques qui vont se créer au niveau moléculaire, tel que les liaisons H entre les nucléotides où la molécules stéroïdienne va venir se fixer.
Schéma des liaisons H au sein de l'ADN
Il y aura ensuite l’obtention d’une molécules qui sera différente que celle qui est attendue lorsque le processus s’est passé normalement. (Même phénomène que les mutations). Ainsi, la fabrication de nouvelles molécules va permettre d’engendrer une hypertrophie musculaire via la synthèse protéïque.